 Онлайн калькулятор
Онлайн калькулятор
 Решение матриц
Решение матриц
 Конвертор величин
Конвертор величин
 Решение кв. уравн.
Решение кв. уравн.
 Таблица Брадиса
Таблица Брадиса
 Тригоном. таблицы
Тригоном. таблицы
 Тесты и игры
Тесты и игры
 Решить задачу
Решить задачу
 Таблица производных
Таблица производных
 Калькулятор дробей
Калькулятор дробей
 Фонетический разбор
Фонетический разбор
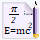 Редактор формул
Редактор формул
Второй закон термодинамики
Согласно закону сохранения энергии в случае определенных процессов, объем используемой энергии остается неизменным. Для того, чтобы объяснить как энергия может превращаться можно обратиться к понятию второй закон термодинамики. Данный закон подтверждает необратимость некоторых явлений в природе и указывает траекторию энергетических изменений внутри определенных процессов. Закон был сформулирован на основе наблюдений за происходящее в природе, что позволило понять сущность и характер протекания определенных явлений. Все законы физики основаны на опытах и наблюдениях и позволили формулировать определенные заявления на основе происходящего в природе.
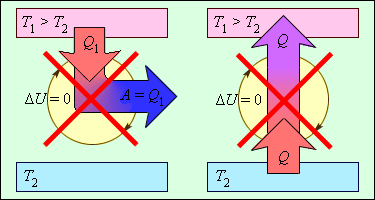
В качестве основы для второго закона термодинамики стали необратимые и непроизвольные процессы, которые происходят исключительно в одно направление и/или без постороннего внешнего воздействия. Классические примеры таких процессов это старение, смерть. Без того чтобы обобщать, можно обратиться к более простым процессам: духи распространяются очень быстро при распылении, а обратному соединению они не подаются; также легко превратить яйца в омлет, так что обратно в скорлупу их невозможно вернуть.
Закон работает в изолированных системах, но также может восприниматься как рабочим в случае систем, у которых есть возможность получить тепло извне. В подобных системах энтропия будет расти даже быстрее. Показатель энтропии указывает на систему с характером неупорядоченности, то есть сама энтропия и есть мера беспорядка. Высокий показатель энтропии это высокий уровень хаотичности движения частиц внутри системы. Классический пример этого состояния это превращение льда в воду и его невозможность стать снова льдом самостоятельно. В случае превращения воды в лед должно происходить понижение уровня энтропии.
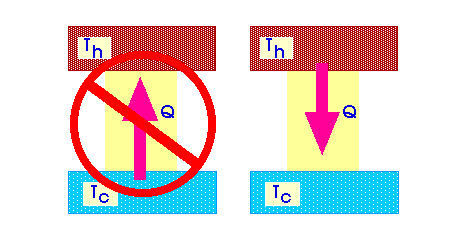
Говоря о том, что такое термодинамика второй закон необходимо вспомнить, что собой представляет первый закон термодинамики. Он олицетворение всех известных процессов в природе и соблюдается с 100% точностью. Все что может противоречить этому закону, в природе не существует. Данный закон ничего не отрицает, но и не утверждает, а в качестве вспомогательного элемента для разъяснения определенных процессов вступает второй закон термодинамики, всем известный в разных формулировках. Невзирая на то, что закон простой, он часто интерпретируется некорректно.
Второй закон термодинамики появился, как необходимость определить направление физических процессов определенные первым законом. В первую очередь необходимо отметить, что разные виды энергии обладают различной способностью перевоплощаться в другую энергию. Существует ограничение, которое не позволяет внутренней энергии стать механической энергии и это разъясняется законами термодинамики.
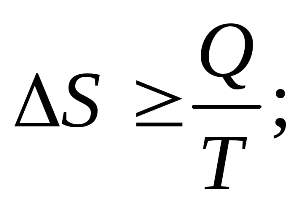
Второй закон термодинамики в различных формулировках
Существует несколько формулировок данного закона, которые объясняют одну правду различными способами. Первый кто сформулировал его это Р. Клаузиус, после последовали формулировки Томсона, Больцмана, Кельвина. Наличие различных интерпретации данного закона позволяет его понять лучше. Поэтому будет не лишним ознакомиться с каждым из них.
1. Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен. (Клаузиус)
2. Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела. (Томсон)
4. Периодические процессы, происходящие исключительно за счет теплоты единого источника являются невозможными. Создание вечного теплового двигателя, который совершал бы механические процессы за счет потери тепла любого тела, является невозможным. (Кельвин).
Согласно всем формулировкам можно условно определить, что процессы можно называть необратимыми, если механическая энергия проходит путь модификации во внутренней энергии при наличии процесса трения. Отсутствие параметра трение позволило бы в ином случае получать обратное протекание процессов. Обратные процессы можно считать абстрактными с учетом того, что протекают они, как правило, в присутствии реакции теплообмена и трения.
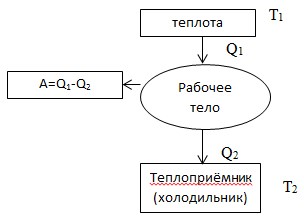
Второй закон термодинамики формулы
Существуют определенные уравнения, которые помогают рассматривать второй закон термодинамики согласно более конкретным данным. Основное уравнение это уравнение Больцмана, которое позволяет вычислять параметр энтропия.
С целью понять, что собой представляет параметр энтропия можно рассмотреть пример с системой, в которой два тела с не одинаковой температурой будут обмениваться теплом, пока температура обоих тел не сравнится. Тепло будет передаваться исключительно от тела с температурой выше к более холодному. Тело, которое отдает тепло, получает пониженный уровень энтропии, только не по тем параметрам, по которым увеличиться энтропия тела, получившее это тепло. Энтропия обеих тел по итогам после процесса передачи тепла будет выше для всей системы. Это указывает, что данная величина стремиться к энному максимуму для всех закрытых систем. Также неопровержимо заявление относительно того, что действие по передаче тепла будет продолжать происходить самопроизвольно, пока будут существовать перепады температуры.
- Блог пользователя zakony
- Войдите на сайт для отправки комментариев


 Образовательный портал
Образовательный портал Reshit.ru может исчезнуть — нужна ваша поддержка!
Reshit.ru может исчезнуть — нужна ваша поддержка!